非酒精性脂肪性肝炎(NASH),是近年來行業(yè)公認的待解決疾病,擁有廣泛的患病人群和醫(yī)藥市場需求。
據(jù)弗若斯特沙利文預測,到2025年全球NASH藥物市場將>100億美元,并于2030年>300億美元。當前,已有數(shù)百個藥物進入到臨床開發(fā),但尚未有品種獲FDA批準。
在挺進NDA和臨床III期的品種當中,筆者對熱門品種進行重點信息梳理,以最快、最直觀的展現(xiàn)NASH領(lǐng)域的重點品種特點。
01
“意難平”的奧貝膽酸
奧貝膽酸是InterceptPharmaceuticalsInc開發(fā)的一款FXR激動劑,最早于2016年獲美國FDA批準上市,適應癥為膽汁性肝硬化,后于EMEA批準用于原發(fā)性膽汁性膽管炎的治療。
對于NASH適應癥的開發(fā),奧貝膽酸在該領(lǐng)域處于第一梯隊。早在2015年,該品種就在適應癥NASH肝纖維化方面獲得FDA的突破性療法認定,且是第一個在NASH領(lǐng)域進入到臨床III期的品種,并進展到美國FDA方面的注冊申請。但遺憾的是,在今年上半年,開發(fā)公司Intercept官宣FDA再次拒絕該品種的注冊申請,并在回復函中提到“在NASH中重新提交的NDA至少需要成功完成REGENERATE研究的長期臨床結(jié)果”,多次負面結(jié)果的疊加也導致了奧貝膽酸在NASH領(lǐng)域的階段性研究暫停。
進一步從數(shù)據(jù)來看,早期REGENERATE公開的數(shù)據(jù)顯示:治療18個月時,奧貝膽酸高劑量組中23%的患者實現(xiàn)了纖維化改善≥1級且NASH無惡化,而安慰劑組僅達到12%,但高劑量組瘙癢發(fā)生率高達51%,而安慰劑組僅為19%;同時奧貝膽酸會導致LDL-C升高,以及存在潛在的心血管風險。二次中期數(shù)據(jù)分析顯示,高劑量組有22.4%患者的纖維化改善≥1級且NASH無惡化,安慰劑組為9.6%,但高劑量組瘙癢發(fā)生率55%,安慰劑組為24%。
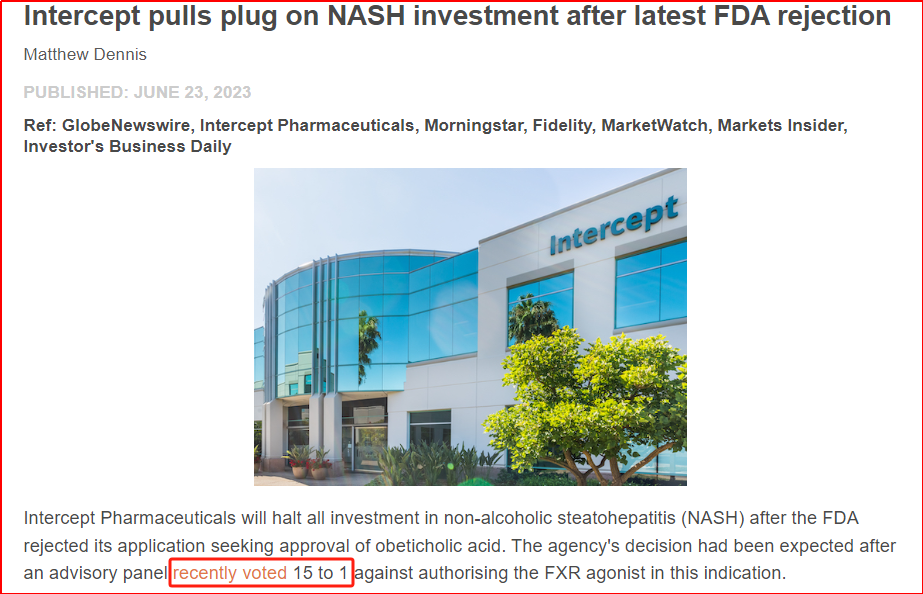
圖1FDA拒絕&Intercept暫停NASH投資
圖片來源:https://firstwordpharma.com/story/5754177
02
瑞司美替羅挺進NDA
行業(yè)關(guān)注度較高的THRβ激動劑瑞司美替羅(Resmetirom),已于2023年7月開展了注冊申請工作,是目前最具潛力獲FDA批準的NASH品種。
瑞司美替羅的開發(fā)公司為Madrigal,最初由羅氏開發(fā),并于2016年開展相關(guān)的NASH研究,2019年于多個國家開展III期臨床,并主推NASH。2023年上半年,該品種獲FDA突破性療法認定,2023年7月進行注冊申請,適應癥為“非酒精性脂肪性肝炎伴肝纖維化”,且當前已納入優(yōu)先審評。
為了推進該品種在NASH適應癥的突破,Madrigal已經(jīng)開展4個III期臨床,以證明該品種的安全有效。2023年11月,Madrigal公開了MAESTRO-NASH的部分試驗結(jié)果:給藥100mg瑞司美替羅,約70%患者存在≥30%的MRI-PDFF,而≥30%MRI-PDFF與NASH的緩解(96%的患者)和纖維化的改善(88%的患者)關(guān)聯(lián)度極高。該組MRI-PDFF總體中位降低率為52%。另,該品種耐受性方面,主要為輕度和短暫性腹瀉以及輕度惡心。
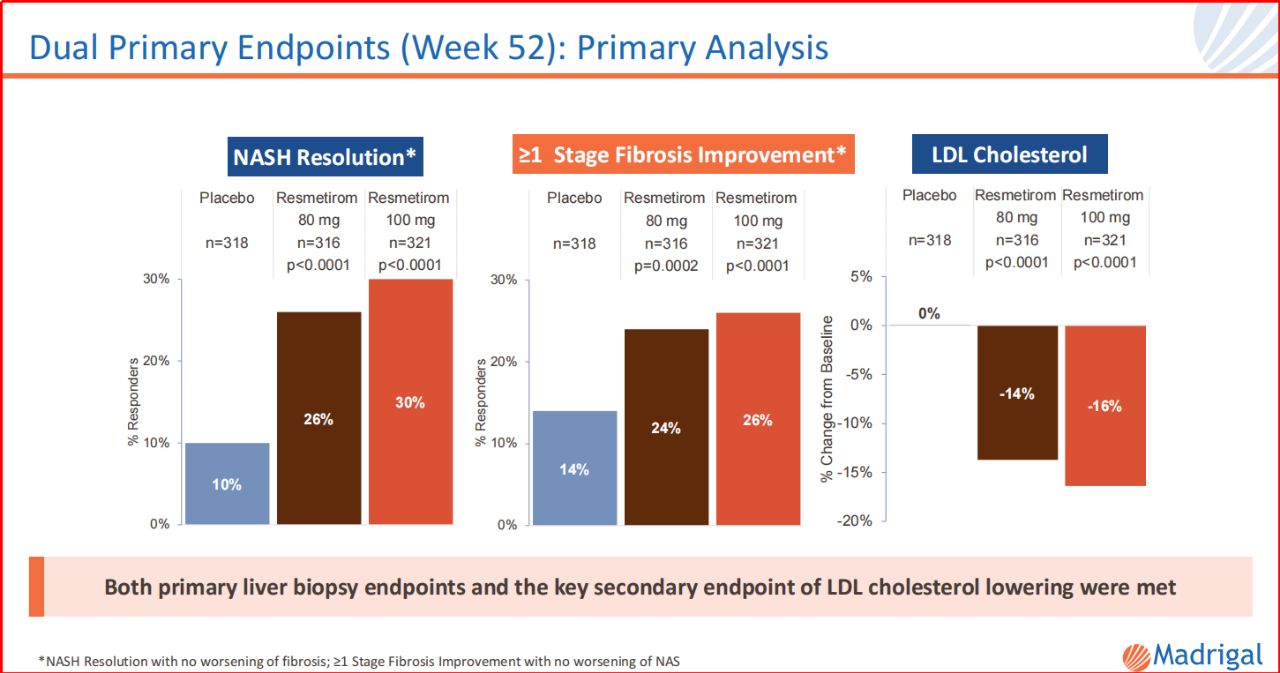
圖2MAESTRO-NASH主要終點分析
圖片來源:https://ir.madrigalpharma.com/static-files/e8a35f47-f841-49d4-9c21-781f41177609
03
“火出圈”的司美格魯肽
Semaglutide,憑借在GLP-1領(lǐng)域的大放異彩,已經(jīng)成為整個藥物研發(fā)領(lǐng)域的全明星品種,熱度不亞于曾經(jīng)的O藥、K藥,臨床主要用于治療2型糖尿病和肥胖。
2020年12月,司美格魯肽在NASH領(lǐng)域的藥物研發(fā)已經(jīng)進入臨床III期,且相繼于多個國家和地區(qū)啟動臨床(包括中國)。2023年3月,還啟動了相關(guān)非酒精性脂肪性肝炎相關(guān)肝硬化的臨床工作。
II期臨床NN9931-4296(NCT02970942)研究結(jié)果:Semaglutide(0.1mg、0.2mg、0.4mg)VS安慰劑組,72周NASH病理消退且肝纖維化未進展的患者比例為40%、36%、59%vs17%,達主要終點。PS:受試人群為NASH合并肝纖維化(F1-3期)。
另,司美格魯肽還啟動了與FXR激動劑cilofexor/ACC抑制劑firsocostat聯(lián)用的工作,結(jié)果顯示:司美格魯肽單藥組觀察到NASH和肝纖維化的改善,聯(lián)合組進一步提升療效;且無論是單藥組還是聯(lián)合用藥組均表現(xiàn)了較好的耐受性。
在中國,NASH方面的臨床試驗為CTR20211818,題目為“Semaglutide對非肝硬化性非酒精性脂肪性肝炎受試者的影響”,主要終點為“脂肪性肝炎緩解且肝纖維化無惡化(是/否)-72周”、“肝纖維化改善且脂肪性肝炎無惡化(是/否)-72周”和“至首例肝臟相關(guān)臨床事件的時間(復合終點)-240周”。
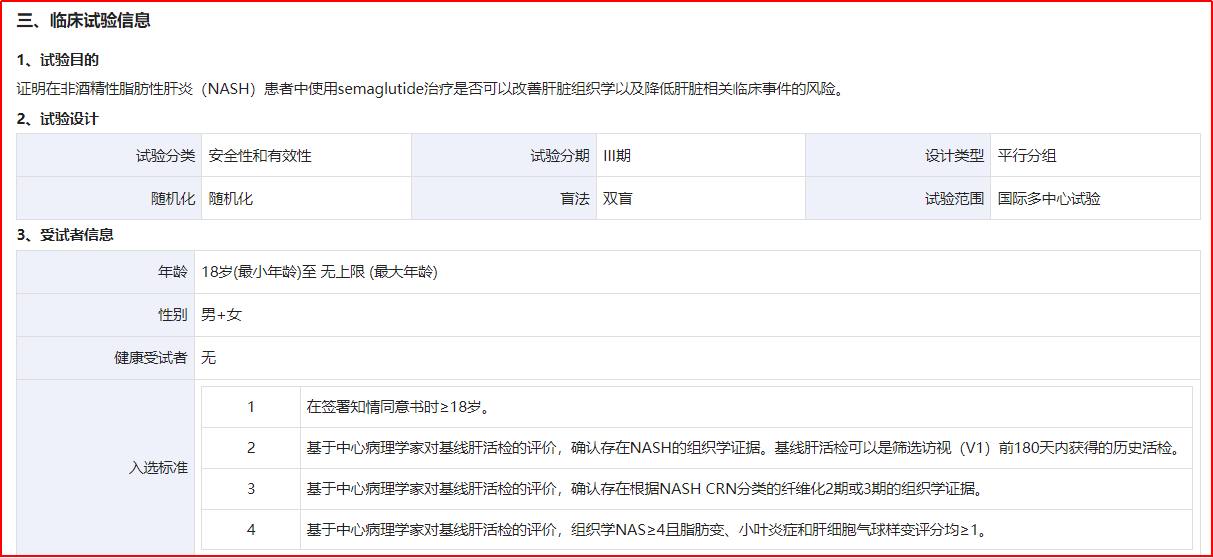
圖3Semaglutide-CTR20211818試驗信息
圖片來源:http://www.chinadrugtrials.org.cn/clinicaltrials.searchlistdetail.dhtml
04
Lanifibranor,正大天晴重倉開發(fā)
PPAR激動劑家族,是NASH藥物開發(fā)的重要組成,當前國內(nèi)外關(guān)注度較高的應為Lanifibranor,以開發(fā)NASH適應癥為首要方向。該品種的原研公司為Inventiva,后正大天晴藥業(yè)參與到該品種的開發(fā)當中,當前已進入到臨床III期,且分別于美國、中國獲得突破性療法認定。
該品種II期臨床數(shù)據(jù)顯示:受試者為伴有肝脂肪變性和中重度壞死性炎癥且無肝硬化的NASH患者,給藥lanifibranor1200mg,試驗組脂肪變性活動性纖維化(SAF)活動度評分至少降低2分且肝纖維化不惡化的患者比例顯著高于安慰劑組。另,受試者為伴2型糖尿病患者,給藥lanifibranor800mg,試驗組肝臟脂肪含量相比安慰劑組顯著下降。試驗期間,lanifibranor的安全性顯示胃腸道事件的發(fā)生率增加(如腹瀉和惡心),以及外周水腫。
國內(nèi),Lanifibranor共登記兩項臨床試驗,分別為“評價Lanifibranor單次和多次給藥的藥代動力學特征和安全性(CTR20233135)”和“評價lanifibranor治療無肝硬化、伴2期(F2)/3期(F3)肝纖維化的非酒精性脂肪性肝炎(NASH)有效性和安全性(CTR20232876)”。
其中,CTR20232876為一項III期臨床,目的為“旨在評價lanifibranor在NASH伴肝纖維化成人受試者中的作用。主要隊列兩個周期的主要目的是:雙盲安慰劑對照(DBPC)期(A部分)評估與安慰劑相比,lanifibranor在NASH緩解同時經(jīng)肝組織學評估纖維化改善方面的效果。雙盲試驗藥擴展(ATE)治療期(B部分)評估DBPC期后lanifibranor的安全性。”

圖4Lanifibranor-CTR20232876臨床終點設定
圖片來源:http://www.chinadrugtrials.org.cn/clinicaltrials.searchlistdetail.dhtml
05
試驗設計&終點選擇,
是機會也是挑戰(zhàn)!
近年來,NASH藥物開發(fā)的大環(huán)境已經(jīng)發(fā)生了重大變化,特別要關(guān)注監(jiān)管方的動向。2021年1月,F(xiàn)DA提出了這類藥物獲批的另一種途徑,即申辦方需要進行2項III期試驗,一項是在高危NASH人群中使用肝臟組織學作為替代終點,另一項是在代償性肝硬化人群中使用主要不良事件作為終點,來共同證明有效性和安全性,基于此將可能獲得對伴有F2-F4纖維化NASH的完全批準。因此,一些申辦方開始嘗試并更改臨床計劃及終點設定。
而我國,2019年CDE發(fā)布了《非酒精性脂肪性肝炎治療藥物臨床試驗技術(shù)指導原則(試行)》,并明確重點指標評價“有效性評價終點包括臨床結(jié)局終點和肝組織學替代終點,以及血清生化檢查、影像學檢查等其他探索性終點”。
另,對于確證臨床獲益的試驗,鑒于組織學改善的替代終點與臨床結(jié)局的相關(guān)性尚未確立,應進行臨床試驗確證臨床結(jié)局的獲益。推薦以下復合終點:出現(xiàn)失代償事件(腹水、食管胃底靜脈曲張出血或肝性腦病)、肝移植、MELD評分≥15、肝細胞癌、全因死亡。對于NASH無肝硬化的患者,還包括進展至肝硬化。
表1終點指標評價方法及具體內(nèi)容
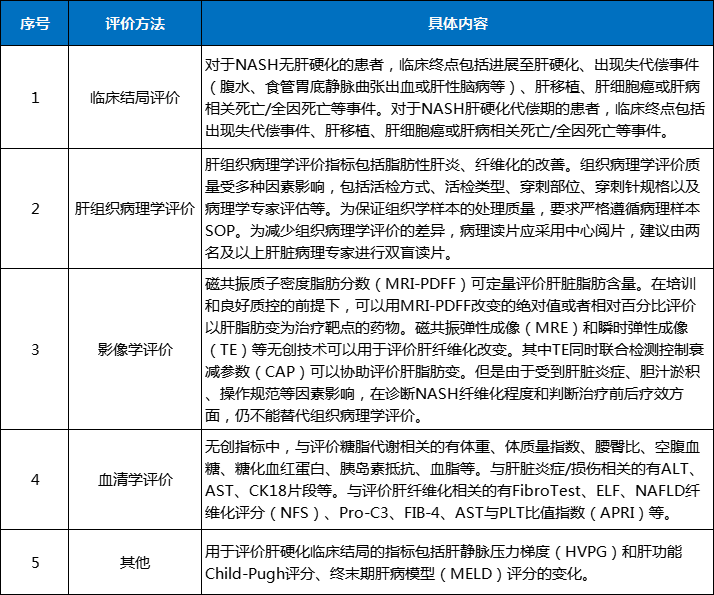
數(shù)據(jù)來源:CDE
06
小結(jié)
總體來看,當前最具潛力的當屬THRβ激動劑Resmetirom,但GLP-1司美格魯肽和正大天晴押寶的Lanifibranor同樣值得期待,其他靶點如FGF21、ACC、CCR2/5自然也少不了該領(lǐng)域研發(fā)人員的持續(xù)關(guān)注,尤其是藥物聯(lián)用方面。
另,從NASH適應癥多年的藥物研發(fā)來看,臨床試驗設計、終點選擇、評價標準等,如何科學、客觀、有力的證明藥物安全有效,需要申辦方深度思考,以從源頭避免出現(xiàn)意難平。
來源:藥智新聞
作者:藥智網(wǎng)/中華小吃

 京公網(wǎng)安備 11010802028547號
京公網(wǎng)安備 11010802028547號