
2023年,美國FDA生物制品評價和研究中心(CBER)批準了5款基因療法(不含細胞療法、小核酸藥物),數(shù)量為歷史新高。
2017年美國FDA批準了Spark Therapeutics治療遺傳性眼疾的基因療法Luxturna,成為FDA批準的第一款用于遺傳疾病的基因療法。不過此后幾年批準的基因療法數(shù)量寥寥,直到2022年、2023年各批準了4個和5個基因療法,揭示了該類型新藥終于迎來爆發(fā)期。
表1. 美國FDA批準的基因療法
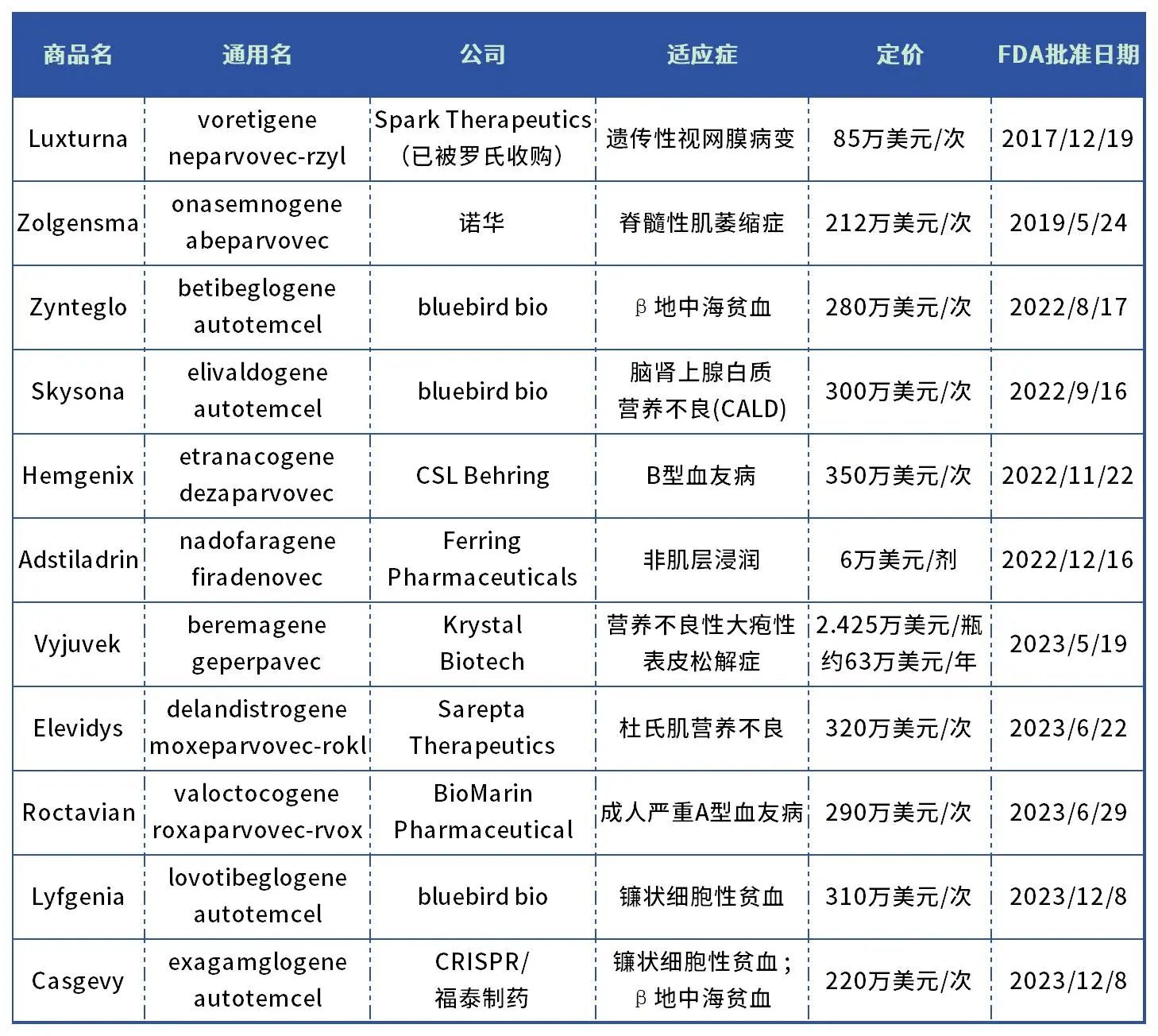
(不含細胞療法、小核酸藥物)
數(shù)據(jù)來源:藥智數(shù)據(jù)、藥智頭條整理
這些基因療法瞄準遺傳性疾病,多數(shù)藥物曾獲得過“孤兒藥”和“重大突破藥”認定,獲批上市對患者意義重大。
另一方面,基因療法高昂的定價爭議頗多。不過基因療法屬于個性化治療、精準醫(yī)療,不僅成本高,而且患者數(shù)量少,藥企想要收回研發(fā)成本定價必然高,短期內(nèi)還看不到下降的可能。據(jù)筆者統(tǒng)計,F(xiàn)DA批準的首個基因療法Luxturna定價85萬美元一次,此后批準的基因療法中,8款超過200萬美元/次,最高達350萬美元/次(約2500萬人民幣/次)。
基因療法定價雖高,但美國醫(yī)藥市場強大的支付能力支持下,不少貴價藥依然取得了不錯的銷售成績。例如,諾華的Zolgensma2022年實現(xiàn)銷售額13.7億美元,Sarepta的Elevidys在2023年6月才獲FDA批準,2023年8月進行銷售交付,小半年就實現(xiàn)銷售額2.004億美元(約14.37億元)。
01 Luxturna
2017年12月,F(xiàn)DA批準了Spark Therapeutics(已被羅氏收購)公司研發(fā)用于治療特定遺傳性眼疾的基因療法Luxturna(voretigene neparvovec-rzyl),這是美國首款上市的針對遺傳性罕見病的基因療法,同時也是首款在美國獲批、靶向特定基因突變的“直接給藥型”的基因療法。
RPE65基因突變引起的RPE65酶水平下降或缺失會讓患者的視力受損,最終導致失明。Luxturna直接在眼內(nèi)注射帶有RPE65基因的腺相關病毒(AVV),使正常功能的RPE65基因在視網(wǎng)膜色素上皮細胞中表達,從而恢復視力。
該藥物單價為42.5萬美元,雙眼治療費用達85萬美元,但如果該藥物不起作用,不會收取全部費用。根據(jù)Spark財報顯示,截至2019年9月Luxturna共取得5500萬美元凈銷售額。2019年10月羅氏宣布收購Spark,此后羅氏未再披露Luxturna的銷售情況。
02 Zolgensma
Zolgensma是由諾華開發(fā)的一款AAV基因療法,于2018年斥資87億美元收購AveXis所得。該療法于2019年5月獲FDA批準上市,用于治療脊髓性肌萎縮癥(SMA)。
SMA是一種罕見的遺傳性神經(jīng)肌肉疾病,是導致兒童死亡的最常見的遺傳病,由編碼運動神經(jīng)元存活蛋白的SMN1基因突變引起。Zolgensma 通過單次靜脈注射即可實現(xiàn)持續(xù)的 SMN 蛋白表達,從而阻止疾病進展。
Zolgensma定價 212.5 萬美元,上市首年Zolgensma就實現(xiàn)銷售額3.61億美元;2020年達9.2億美元;2021年達13.51億美元;2022年達13.7億美元。
03 Zynteglo
Zynteglo由Bluebird bio(藍鳥生物)開發(fā),是首款治療β-地中海貧血癥的基因藥物,于2022年8月獲得FDA批準上市,用于治療需要接受常規(guī)血紅細胞輸注的β地中海貧血患者。
Zynteglo通過慢病毒載體將表達正常血紅蛋白β亞基的基因(βA-T87Q-珠蛋白基因)在體外植入到從患者體內(nèi)取出的造血干細胞中,再將這些細胞回輸入患者體內(nèi),這些造血干細胞在輸注回患者體內(nèi)后,會源源不斷地生成具有正常功能的血紅細胞,極大減少患者對輸血的需求。
該藥物定價280萬美元,不過Zynteglo承諾,如果沒有達到治療效果,將退還80%的治療費用。2023年前三季度Zynteglo銷售額867.8萬美元,約3~4名患者接受了治療。
04 Skysona
Skysona是Bluebird bio(藍鳥生物)開發(fā)的一種一次性基因療法,于2022年9月獲FDA批準用于減緩4-17歲患有早期活動性腦腎上腺腦發(fā)育不良(CALD)的男性患者的疾病進展。
CALD是一種X連鎖的隱性遺傳神經(jīng)退行性疾病,是腎上腺腦白質(zhì)營養(yǎng)不良癥的一種較為嚴重的表型,由致病基因ABCD1的突變引起。Skysona利用Lenti-D慢病毒載體(LVV)進行體外轉(zhuǎn)導,將ABCD1基因的功能拷貝添加到患者自身的造血干細胞(HSC)中,功能性ABCD1基因的加入能使患者體內(nèi)產(chǎn)生ALD蛋白。SKYSONA治療的目的是穩(wěn)定CALD的進展,從而盡可能地保留神經(jīng)功能,包括保留運動功能和溝通能力。
該療法定價為300萬美元,2023年前三季度銷售額1086萬美元,約有3~4名患者接受治療。
05 Hemgenix
目前CSL Behring和uniQure的血友病藥物Hemgenix以350萬美元的價格位列全球最貴藥物榜首,2023年6月,CSL Behring和uniQure宣布首名患者接受了B型血友病基因療法Hemgenix治療,完成商業(yè)化首單,尚未實現(xiàn)大范圍推廣。
Hemgeni是CSL Behring開發(fā)的一款基于AAV5載體的基因療法,該藥物搭載有凝血因子IX(FIX)基因變體(FIX-Padua),通過靜脈給藥,給藥后該基因可在肝臟中表達FIX 凝血因子,分泌后進入血液發(fā)揮凝血功能,從而達到治療目的,理論上一次給藥長期有效。該療法于2022年11月獲FDA批準上市,用于治療處于凝血IX因子預防性輸血治療階段,以及曾經(jīng)出現(xiàn)過危及生命的出血事件,或出現(xiàn)反復嚴重的自發(fā)性出血事件的成年B型血友病患者。這是全球首款治療血友病B成人患者的基因療法。
該產(chǎn)品定價350萬美元一劑,是目前全球最貴藥物。盡管價格高昂,但CSL Behring認為該藥物將“為整個醫(yī)療保健系統(tǒng)節(jié)省大量成本”,并“通過降低年出血率、減少或消除預防性治療和保持多年的高IX因子水平,顯著降低B型血友病患者的經(jīng)濟負擔”。
06 Adstiladrin
Adstiladrin(nadofaragene firadenovec)由Ferring Pharmaceuticals開發(fā),于2022年12月獲美國FDA批準,用于治療卡介苗(BCG)無效的高危非肌肉浸潤性膀胱癌(NMIBC)的原位癌(CIS)與或非乳頭狀腫瘤的成年患者。這是首個被批準用于膀胱癌的基因療法。
NMIBC是膀胱癌的一種亞型,它也被稱為“淺表”膀胱癌,在新診斷出患有膀胱癌的人中,大約75%患有NMIBC。BCG(卡介苗)仍然是高級別NMIBC患者的一線治療標準。然而,超過 50% 接受BCG初始治療的患者將在一年內(nèi)出現(xiàn)疾病復發(fā)和進展,其中許多發(fā)展為對BCG無反應的疾病。Adstiladrin是一種基于非復制型腺病毒載體的基因療法,含有干擾素alfa-2b基因,這種新穎的基因治療方法可將患者自身的膀胱壁細胞轉(zhuǎn)變?yōu)楦蓴_素微工廠,從而增強人體對癌癥的天然防御能力。
Adstiladrin每3個月通過膀胱內(nèi)灌注進行一次,定價為每單位劑量6萬美元。
07 Vyjuvek
Vyjuvek是Krystal Biotech公司開發(fā)的一種外用基因療法,于2023年5月獲FDA已批準,用于治療6個月大及以上年齡的營養(yǎng)不良性大皰性表皮松解癥(DEB)。這是FDA批準的首個可重復給藥的外用基因療法,同時也為DEB患者帶來了首款獲批基因療法。
DEB患者也被稱為“蝴蝶寶寶”,是由COL7A1基因中的一個或多個突變引起的一種罕見的遺傳性皮膚病。由于患者缺乏功能性錨定纖維,導致皮膚或黏膜受到輕微外傷或摩擦后會出現(xiàn)破損、水皰或撕裂。
Vyjuvek使用單純皰疹病毒1型(HSV-1)作為基因遞送載體,大概每周使用一次,可以直接涂抹在患者皮膚傷口處,通過恢復患者角質(zhì)形成細胞和成纖維細胞中COL7的表達來實現(xiàn)治療作用。Vyjuvek臨床試驗數(shù)據(jù)顯示,局部給藥B-VEC療法能夠顯著促進DEB患者在3個月和6個月時的傷口完全愈合。
該療法用藥每瓶售價為24250美元,患者平均每年使用26瓶,每年治療費用約63萬美元,經(jīng)過政府強制折扣后為48.5萬美元。
08 Elevidys
Elevidys是Sarepta Therapeutics公司和羅氏(Roche)聯(lián)合開發(fā)的一種基因替代療法,于2023年6月獲FDA批準,用于治療4至5歲杜氏肌營養(yǎng)不良患者。這是全球首個治療杜氏肌營養(yǎng)不良癥(DMD)的一次性基因療法。
DMD是一種致命的、多發(fā)于男性的罕見X連鎖退行性神經(jīng)肌肉疾病,由于患者體內(nèi)抗肌萎縮蛋白(dystrophin)基因的突變或缺失,無法產(chǎn)生相應蛋白維持骨骼肌及其他組織細胞膜的穩(wěn)定性,導致肌肉組織萎縮或變性,最終由于呼吸或心臟衰竭死亡。Elevidy通過將正常的基因輸注到患者體內(nèi),該療法幫助患兒持續(xù)產(chǎn)生具有抗肌萎縮蛋白功能的重組蛋白。
在Elevidys獲批前,全球有4款治療DMD的“外顯子跳躍”療法,其中3款都來自Sarepta這家公司。但這些療法需定期注射給藥,且臨床療效都并不理想。Elevidys作為一種基因替代療法,目標是實現(xiàn)一次性給藥,無論患者的基因突變出現(xiàn)在抗肌萎縮蛋白基因的何處,都能從根本上替代有缺陷的基因。該療法定價為320萬美元一針。2023年8月,Elevidys進行銷售交付,2023年Elevidys銷售額約2億美元(約14億人民幣)。
09 Roctavian
Roctavian(valoctocogene roxaparvovec)是BioMarin開發(fā)的一種基因療法,于2023年6月獲FDA批準,一次性單劑量輸注用于治療嚴重 A 型血友病。這是首個獲FDA批準治療嚴重血友病A患者的基因療法。
血友病A(HemophiliaA,HA)是一種罕見遺傳性出血性疾病,患有嚴重A型血友病的成年人面臨終生負擔,需要頻繁輸液,并且出現(xiàn)健康并發(fā)癥的風險很高。Roctavian是一款通過使用AAV5病毒載體遞送表達凝血因子Ⅷ的轉(zhuǎn)基因的基因療法,旨在取代突變基因的功能,使患有嚴重 A 型血友病的患者能夠產(chǎn)生自己的 FVIII,從而限制出血事件。Roctavian定價為290萬美元,雖然價格高昂,但如果可以讓患者凝血因子恢復一定的水平,不需要反復輸注,患者獲益依然可觀。
10 Lyfgenia
Lyfgenia(Lovo-cel;lovotibeglogene autotemcel)是Bluebird bio(藍鳥生物)開發(fā)的一種一次性基因療法,2023年12月獲FDA批準用于治療12 歲及以上患有復發(fā)性血管閉塞危象 (VOC) 的鐮狀細胞病 (SCD) 患者。
Lyfgenia是一款基于慢病毒載體的細胞基因療法,通過慢病毒載體將功能性β珠蛋白基因永久添加到患者自身的造血干細胞(HSC)中,可持久產(chǎn)生具有抗鐮狀細胞特性的血紅蛋白(HbAT87Q型),HbAT87Q型與野生型 HbA 具有相似的氧結合能力,限制紅細胞鐮狀化,并有可能減少血管閉塞事件 (VOE)法。該療法售價為310萬美元,是市場上第三昂貴的療法。
11 Casgevy
2023年11月,全球首款CRISPR/Cas9基因編輯藥物Casgevy(Exa-cel; exagamglogene autotemcel )在英國批準上市,用于治療12歲及以上輸血依賴性β地中海貧血(TDT)或伴有復發(fā)性血管閉塞危象(VOC)的鐮狀細胞病(SCD)患者。12月8日,Casgevy獲美國FDA批準用于SCD,2024年1月,F(xiàn)DA又批準了TDT。
Casgevy是由CRISPR Therapeutics和Vertex共同推出的一款自體、ex vivo CRISPR/Cas9基因編輯藥物,該療法需要先提取患者自身的造血干細胞,再通過電轉(zhuǎn)的方式將CRISPR/Cas9系統(tǒng)遞送到造血干細胞,靶向BCL11A紅細胞系特異性增強子并且特異性沉默BCL11A基因,重新激活胎兒血紅蛋白(HbF)的生成并表達高水平的HbF,從而緩解TDT患者的輸血需求,減少SCD患者的疼痛和血管閉塞性危象。
CRISPR/Cas9是目前主流的基因編輯技術,Casgevy的獲批標志基因治療領域的又一大里程碑。
Casgevy一次性治療定價為220萬美元,低于藍鳥生物SCD基因療法Lyfgenia的310萬美元和TDT基因療法Zynteglo的280萬美元。
來源:藥智頭條 作者:游游

 京公網(wǎng)安備 11010802028547號
京公網(wǎng)安備 11010802028547號